Desarrollo Testicular e Inicio de la Espermatogénesis

En la Fisiología Reproductiva del Búfalo los testículos son los órganos primarios del sistema reproductivo de los machos y desempeñan dosfunciones principales, la espermatogénesis y la esteroidogénesis. Estas dos funciones son realizadaspor dos unidades básicas de los testículos, los túbulos seminíferos y las células intersticiales (Leydig). Los túbulos seminíferos producen espermatozoides viables y potencialmente fertilizantes a partirde las capas de epitelio germinal, por medio de una serie de divisiones celulares y las célulasintersticiales (Leydig), las cuales se encuentran entre los túbulos seminíferos, producen andrógenoso la hormona sexual masculina, testosterona. En el búfalo maduro, los túbulos seminíferos ocupanalrededor del 82% de los testículo (Pawar 1991).
En la Fisiología Reproductiva del Búfalo Durante la vida fetal, los testículos son intra-abdominales y comienzan a migrar a la región inguinalalrededor del día 110 de la gestación. El descenso de los testículos dentro del saco escrotal es casi completo alrededor del día 243 de gestación. El descenso de los testículos desde la cresta genital en el feto a una localización extra-corporal es un proceso de desarrollo obligatorio para asegurar que los testículos maduros produzcan una espermatogénesis normal.
Al inicio de la vida fetal, los túbulos seminíferos se desarrollan como cordones sexuales sólidos sinlumen. Estos cordones sexuales sólidos contienen células de Sertoli periféricas primitivas y célulasgerminales grandes situadas en el centro (gonocitos). La primera gónada indiferenciada fueobservada en un embrión de búfalo en el Día 43 como una estructura nodular unida medialmente almesonefros (Roy et al 2009). Alrededor del Día 47 los embriones desarrollan la túnica albugínea y estructurassimilares al cordón testicular (Roy et al 2009). Alrededor del Día 65 de edad fetal, los túbulos seminíferos estánpresentes en la periferia gonadal y se ve en el centro de los testículos una red de células poligonalesmesenquimales. Las células pre-Sertoli se observan por primera vez en esta etapa en la periferia delepitelio de los túbulos seminíferos, mientras que los gonocitos pueden observarse en el centro delos túbulos alrededor del Día 76 de edad fetal. Las células fetales de Leydig también se encuentranalrededor del Día 65, sin embargo, después del Día 92, el intersticio se expande considerablementedebido a la diferenciación de las células mesenquimales a células de Leydig. El número de túbulosseminíferos así como su diámetro se incrementa a medida que avanza la edad del feto (Kaur 2011). Lagónada indiferenciada del embrión macho se transforma finalmente en testículo alrededor del Día300 de gestación (Roy et al 2009).
Al nacimiento, los túbulos seminíferos aún son sólidos y tienen células de pre-Sertoli y gonocitos detamaño reconocible. Están presentes grandes espacios intertubulares entre los túbulos seminíferossólidos. A medida que avanza la edad, los gonocitos centrales migran hacia la periferia del cordónsexual y entran en una serie de divisiones mitóticas para formar las pre-espermatogonias, dandolugar a las futuras generaciones de espermatogonias. La rápida proliferación de contenidostubulares se produce a los 12 meses de edad y se observan las células de Sertoli totalmentediferenciadas y espermatogonias. A los 12 meses de edad también se forma el lumen de los túbulosseminíferos y se ven las células de Leydig en grupos de dos y tres en los espacios intertubulares quehan estado restringidos debido al agrandamiento de los túbulos seminíferos. El diámetro de lostúbulos seminíferos continúa aumentando. A los 18 meses de edad, por primera vez se presentanclaramente las espermátidas redondas y alargadas en gran número. Se completa la formación dellumen y están presentes células de Leydig solas o en racimos. A los 24 meses de edad, laespermatogénesis activa es evidentemente en la mayoría de los túbulos seminíferos. Por tal razón, elestablecimiento de la espermatogénesis es progresivo desde el nacimiento y se observan cambiosmarcados a los 18 y 24 meses después del nacimiento (Ahmad et al 2011).
También Puedes leer sobre Producción del Búfalo
Pubertad en la Fisiología Reproductiva del Búfalo
En los machos, la pubertad se define como la edad en la cual el eyaculado contiene suficientesespermatozoides para fertilizar una hembra. Se considera que un búfalo reproductor alcanza lapubertad cuando el eyaculado contiene 50 millones de espermas, de los cuales al menos el 10% sonmóviles (McCool et al 1989). En el búfalo, la división de las células espermáticas comienza aproximadamente a los12 meses de edad y la espermatogénesis activa se puede ver desde los 15 meses. Sin embargo, eleyaculado contiene espermatozoides viables solo después de los 24 – 30 meses de edad (Sayed 1962).Esto indica que el búfalo madura más lentamente que el macho bovino [44] tiene un lapso de tiempomás largo entre la aparición de la espermatogénesis y el llegar a la pubertad. En general, los búfalosde rio como los de pantano, alcanzan la pubertad alrededor de los 18 – 24 meses de edad y lamadurez sexual se alcanza solo después de los 2 años de edad, cuando el búfalo puede utilizarsepara la monta natural o para la recolección de semen en un programa de reproducción (Rajamahendran 1987). La edad a la pubertad y la madurez sexual puede variar en las diferentes razas, en elplano nutricional y por factores medioambientales (Narasimha 1979; Bongso 1984).
Regulación endocrina de la espermatogénesis
La secreción de LH en los machos es un factor importante para el desarrollo sexual temprano y elinicio de la espermatogénesis. La supresión de la secreción de LH en esta etapa por lo generalconduce a una demora en el desarrollo testicular. Al nacimiento, la pituitaria no responde a la GnRHexógena. El testículo de los búfalos macho se vuelven sensibles a las gonadotropinas exógenas a laedad de 4 meses y se observan altas concentraciones plasmáticas de testosterona dentro de las 24horas después de una inyección de PMSG (Gunarajasingam 1985). La respuesta a una inyección de HormonaLiberadora de Gonadotropina (GnRH), se incrementa con la madurez sexual como se ha evidenciadopor el aumento de la secreción de testosterona en los búfalos machos de >6 meses de edad (Cosentino 1986).
El mecanismo endocrino exacto que regula la producción de semen y la libido sexual en los búfalosmacho no está bien descrito. Al igual que en el ganado, la función reproductiva en los machos estáregulada por una compleja interacción de las hormonas producidas por el eje hipotálamo-pituitaria-testículo. La GnRH es sintetizada en el hipotálamo y estimula la secreción de LH y Hormona FolículoEstimulante (FSH) por la pituitaria anterior.
Espermatogénesis
La espermatogénesis es un proceso biológico complejo de transformación celular de las célulasespermatogonias a espermatozoides dentro de los túbulos seminíferos del testículo. El epitelioseminífero consiste en células de Sertoli y numerosas capas concéntricas de células germinalesconocidas como espermatogonias en diferentes etapas de transformación celular. Las células deSertoli y las células madre procedentes de las espermatogonias están localizadas a lo largo de lamembrana basal de los túbulos seminíferos. A medida que avanza la espermatogénesis, los gametosen desarrollo migran desde la membrana basal de los túbulos seminíferos hacia el lumen.
El citoplasma de las células de Sertoli se extiende alrededor de todas la células germinales paranutrir y mantener el proceso de espermatogénesis. Las células de Sertoli tienen varias funcionesimportantes que incluyen: suministro de nutriente a las células germinales que se estándiferenciando, compartimentación de los túbulos seminíferos (por una unión estrecha entre lascélulas de Sertoli adyacentes para la protección inmunológica de las células espermáticasdiferenciadas), liberación de espermatozoides de las células de Sertoli dentro del lumen de lostúbulos seminíferos (espermiación), fagocitosis de las células germinales degeneradas y del cuerpocitoplasmático residual que quedan del esperma liberado, secreción de líquido, varias proteínas,hormonas y mediación de la acción de la FSH y la LH. En los mamíferos neonatales, la FSH estimulala proliferación de las células de Sertoli, produciendo un número final de células que se diferencianterminalmente durante la pubertad. Una sola célula de Sertoli diferenciada terminalmente mantienesolamente a un número limitado de células germinales; el número de células de Sertoli determina eltamaño final del testículo en mamíferos (Dhingra 1975).
La espermatogénesis puede dividirse en 6 etapas según las asociaciones celulares características enel epitelio seminífero (Pawar 1991). Se observan grandes pérdidas celulares en la fase 4 y esto involucra lafracción spermatogonial (Wrobel 1992). Con base en los cambios morfológicos en los detalles nucleares, ladivisión progresiva de la espermatogonia del búfalo puede clasificarse como tipo A (A0, A1, A2),intermedia (In) y tipo B (B1, B2, B3) que finalmente se diferencian en espermatocitos primarios [63].Sin embargo, Bilaspuri y Guraya (Bilaspuri 1980) clasificaron a la espermatogonia como tipo A1, A2, A3, In, B1 yB2 antes de formar el espermatocito primario. Las espermatogonias del macho búfalo sufren 6generaciones de sucesivas divisiones mitóticas para formar un espermatocito primario (Wrobel 1992). Unestudio reciente sobre el búfalo Nili Ravi demostró que la diferenciación de células basales a célulasde Sertoli comienza a los 6 meses de edad y la formación de células de Sertoli se completa a los 12meses. Los espermatocitos fueron vistos por primera vez a los 12 meses mientras que abundantesespermátidas fueron visibles a los 18 meses de edad (Dhingra 1975).
También Puedes leer sobre Reproducción del Búfalo
Secuencia de la espermatogénesis dentro de los túbulos seminíferos
Ambos extremos de cada túbulo seminífero (TS) están conectados a la rete testis formando un bucle.A todo lo largo de este bucle tubular, el proceso de la espermatogénesis no es uniforme. En vez, unTS completo puede segmentarse en asociaciones celulares bien definidas de espermatogonias,espermatocitos y espermátidas en diferentes combinaciones que experimentan cambios dedesarrollo cíclicos. En el búfalo se han identificado hasta 8 asociaciones o estadios celularesdistintos lo que constituye una ola del epitelio seminífero (Hess 2008). Estas asociaciones celulares en elsegmento de los túbulos se disponen en un orden consecutivo de desarrollo y reaparecen en seriescon regularidad cíclica. Es decir, la etapa I es seguida por la etapa II, que es seguida por la etapa III,etc. a través de la etapa VIII, que es seguida de nuevo por la etapa I. El orden secuencial de lasasociaciones o estadios celulares básicos a lo largo de todo el túbulo es conocido como la ola delepitelio seminífero u ola espermatogénica. Un bucle de TS puede contener varias olasespermatogénicas en toda su longitud. Los estado más avanzados de la ola se localizan cerca de larete testis mientras que los estados menos avanzados se localizan en el medio del bucle en donde seencuentra típicamente un sitio de inversión.
El ciclo del epitelio seminífero se define como una serie de cambios en un área dada de epitelioseminífero entre dos apariciones de los mismos estadios de desarrollo (asociaciones celulares). Laduración entre dos apariciones sucesivas de las mismas asociaciones celulares en un lugardeterminado en los túbulos seminíferos varía entre las especies domésticas. En el búfalo, la duracióndel ciclo seminífero es de 8,6 días (Amann 1986). La duración de la espermatogénesis desde el momento de laproducción de la espermatogonia comprometida hasta la espermiación es específica de la especie (Amann 1986, Guraya 1976). La duración total de la espermatogénesis del búfalo está constituida por 4,57 ciclos deepitelio seminífero (Taneja 1986). La duración aproximada de la espermatogénesis es de 38 días en el búfalo[66]. Se produce una pérdida significativa de células germinales durante la espermatogénesis en losmamíferos y solamente 2-3 de 10 espermatozoides son producidos por cada espermatogonia tipoA1 diferenciada (Wrobel 1992).
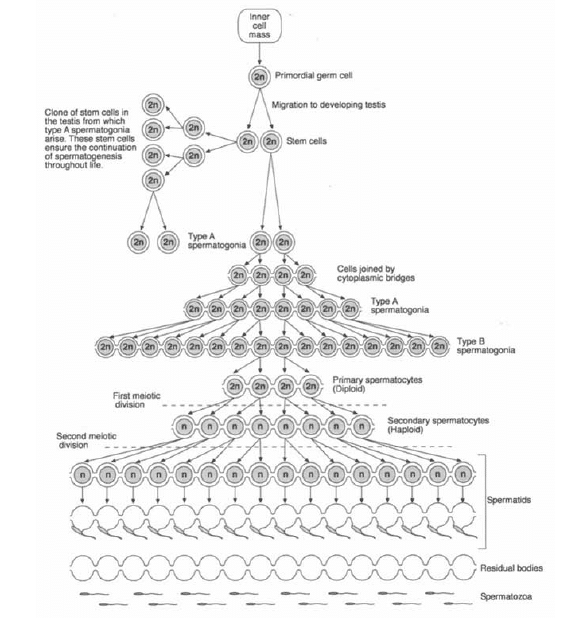
Maduración Espermática
Los espermatozoides producidos en los testículos son inmóviles. Después del proceso deespermiación en el TS, los espermatozoides liberados son transportados a través de la rete testis ylos vasos eferentes hacia el epidídimo, en donde son almacenados. Este tránsito es ayudado por lassecreciones de fluido de las células de Sertoli y la rete testis, el movimiento ciliar del conductoeferente y los elementos contráctiles del testículo.
La maduración espermática es facilitada por las proteínas del plasma seminal que son producidaspor el epidídimo y las glándulas sexuales accesorias que juegan un papel importante durante elproceso. Algunas de estas proteínas se unen a la superficie de los espermatozoides, en dondepueden actuar como compañeros en la unión con las estructuras superficiales en el tracto genitalfemenino.
Barrera sanguínea testicular
Los espermatozoides producidos dentro de los TS son haploides y tienen una población heterogéneade cromosomas X e Y contenidos en las células portadoras de espermatozoides. Por lo tanto, estascélulas espermáticas corren el riesgo de ser atacadas inmunológicamente por el cuerpo diploide.Este ataque es protegido por la presencia de la barrera sanguínea testicular en la cual los túbulosseminíferos no son penetrados por los vasos sanguíneos ni linfáticos; y los TS se compartimentanpor las uniones estrechas de las células de Sertoli adyacentes. La presencia de S-100 beta (proteínasde bajo peso molecular encontradas en los vertebrados y caracterizadas por dos sitios de unión alcalcio e implicadas en una variedad de funciones intracelulares y extracelulares) en las células deSertoli está implicada en el establecimiento de la barrera sanguínea testicular (Cruzana 2003).
Las células deSertoli adyacentes se unen para formar unas uniones estrechas y dividir los túbulos seminíferos endos compartimentos diferentes; el compartimento basal y el compartimento ad-luminal (Guraya 1976). Elcompartimento basal es accesible libremente por los componentes biológicos que han penetradopreviamente la capa mioide del TS. Este compartimento está ocupado por espermatogonias yespermatocitos preleptotenos. Estas células se dividen por mitosis para producir los espermatocitosque son transferidos al compartimento ad-luminal. El compartimento ad-luminal contiene losestadios más avanzados de espermatocitos y espermátidas, que se comunican libremente con ellumen del túbulo. El compartimento ad-luminal es el sitio de la meiosis y la espermatogénesis, la cualcomprende todas las divisiones y cambios morfológicos que deben ocurrir para cambiar lasespermatogonias diploide redonda en espermatozoides haploides altamente especializados ymóviles.
Termorregulación testicular
Los testículos están localizados fuera de la cavidad corporal en una bolsa especializada llamadaescroto. La principal función del escroto es sostener y proteger los testículos. El escroto mantiene alos testículos 2-3 grados Celsius por debajo de la temperatura corporal normal, lo cual se requierepara la espermatogénesis normal (Rahman 2011). Aumentar la temperatura de los testículos, por el aislamiento,resulta en una disminución de la motilidad, aumento de la morfología anormal y la interrupción de laprotaminación nuclear (Abdel-Raouf 1974). La delgada piel escrotal, la ausencia de pelo escrotal, la presencia demúsculos de la túnica dartos, un gran número de glándulas sebáceas y sudoríparas en el escrotoayudan a disminuir la temperatura escrotal. El plexo pampiniforme de los testículos tambiénpreviene el calentamiento excesivo del testículo debido a su angio-arquitectura (Dhingra 1979). Durante laestación de calor, los músculos de la túnica dartos se relajan y los testículos cuelgan lejos del calordel cuerpo. Mientras que en la estación fría, los músculos escrotales se contraen y retraen el escrotopara acercar a los testículos al cuerpo. La calidad del semen en el búfalo refleja el grado denormalidad de la función de sus testículos, conductos epididimales y de las glándulas sexualesaccesorias.
Epidídimos
El epidídimo es un tubo altamente convulsionadas, en espiralo que se une al exterior de lostestículos y conecta los conductos eferentes del testículo a los conductos deferentes. El epidídimoconsta de tres segmentos principales: la cabeza (caput), el cuerpo (corpus) y la cola (cauda). Elepidídimo del bovino puede alcanzar una longitud de 40 metros (Abdel-Malak 1992). El tiempo del tránsitoepididimal varía entre los toros pero promedia 8 días, con un rango de 4 a 15 días (Bezuidenhout 1995).
La cola del epidídimo es el principal órgano de almacenamiento que guarda más del 60% del total dela reserva espermática epididimal. Las principales funciones de los epidídimos son la maduración delos espermatozoides, el transporte, la concentración, la protección y el almacenamiento que resultaen una población heterogénea de espermatozoides que se vuelven móviles y son capaces defertilizar ovocitos (Bezuidenhout 1995). Se comparó la motilidad de los espermatozoides del búfalo Africanoalmacenados en los epidídimos durante 5 días a 4°C (Abdel-Rahman AA 1980). Se observó una disminución significativade la motilidad en las primeras 8 horas de almacenamiento (60% a 50%) pero esta permanecióconstante hasta 64 horas de almacenamiento epididimal refrigerado (40% a 30%). Después de 5 díasde almacenamiento dentro de los epidídimos, todavía fue posible la recolección de espermatozoidesmóviles (10%).
glándulas sexuales accesorias del búfalo
Las glándulas sexuales accesorias del búfalo adulto intacto varían significativamente en laconcentración de varios elementos excepto que el FE, Ca, Cu y la fructosa están relativamente másconcentrados en las vesículas seminales (Abdou MSS 1982). La próstata tiene la concentración más alta de Zn,mientras las concentraciones más altas de Na, K, Mg y P se encuentran en las glándulasbulbouretrales. La concentración de Cu disminuye significativamente en los búfalos viejos. Lacastración resulta altamente significativa de la concentración de Zn en todas las glándulasaccesorias (Abdou MSS 1982). La distribución de los nervios noradrenérgicos y los que contienen péptidos durantela temporada de apareamiento en los bufalos machos reveló una inervación densa de los conductosdeferentes, así como también de los otros órganos genitales accesorios en comparación con lainervación durante el período de no apareamiento (Mirabella 2007).
Producción de esperma en el búfalo
Los espermatozoides son producidos continuamente dentro de los túbulos seminíferos. Laproducción diaria de espermatozoides por gramo de parénquima testicular es una medida de laeficacia espermatogénica en animales sexualmente maduros y es útil para la comparación deespecies. La eficiencia de la producción de espermatozoides en búfalos de pantano y de rio, esbastante uniforme y promedia de 13 a 14 x 106 espermatozoides por gramo de parénquimatesticular por día. La producción real de espermatozoides es más alta porque todos losespermatozoides producidos no pueden ser recolectados. En el búfalo macho, existe una correlaciónpositiva significativa entre la circunferencia escrotal y el volumen del semen y la concentración poreyaculado, lo que indica que la circunferencia escrotal es un indicador útil de la producción potencialde esperma y puede servir como un criterio importante para seleccionar toros jóvenes para lainseminación artificial. La producción diaria de espermatozoides en los búfalo Murrah es casi un45% menor en comparación con los toros Holstein de la misma edad, presumiblemente debido a quela circunferencia escrotal es casi 40% menor (Pant 2003).
Referencias Bibliográficas
Abdel-Malak G, Essawi SA, Youssef, et al. Testicular response to GnRH in buffalo bull. Anim Reprod Sci 1992; 27:123-128.
Abdel-Raouf M, El-NaggarMA, Fateh El-BabMR. The development of the fetal testis in the buffalo. Zeitschriftfür Anatomie und Entwicklungsgeschichte1974; 144:227-236.
Abdel-Rahman AA. Spermatogenesis and sperm maturation in buffalo bulls. MVSc. Thesis, Cairo Univ (1980).
Abdou MSS, El Sayed MAI, Seida AA, et al. Gonadal and epididymal sperm numbers in adult buffulo bulls. Vet Med J Giza 1982; 30:327.
Ahmad N, Umair S, Shahab M, et al. Testicular development and establishment of spermatogenesis in Nili-Ravi buffalo bulls. Theriogenology 2011; 73:20–25.
Amann RP. Detection of alterations in testicular and epididymal function in laboratory animals. Environ Health Perspect 1986; 70:149–158.
Bezuidenhout C, Fourie FR, Meintjes M, et al. Comparative epididymal sperm cell motility of African ungulate and equid game species stored at 4°C. Theriogenology 1995; 43:167.
Bilaspuri GS, Guraya SS. Quantitative studies on spermatogenesis in buffalo (Bubalus bubalis). Reprod Nutr Dev 1980; 20:975-982.
Bongso TA, Hasan MD, Nordin W. Relationship of scrotal circumference and testicular volume to age and body weight in swamp buffalo. Theriogenology 1984; 22:127-134.
Cosentino MJ, Cockett AT. Structure and function of the epididymis. Urol Res 1986; 14:229-240.
Cruzana MB, Budipitojo T, De Campo G, et al. Immuno-histochemical distribution of S-100 proetin and subunits (S-100 alpha and S-100 –beta) in the swamp type water buffalo (Bubalus bubalis) testis. Andrologia 2003; 35:142-145.
Dhingra LD. Angioarchitexture of the buffalo testis. Anat Anz 1979; 146:60-68.
Dhingra LD, Goyal HO. A study on different types of spermatogonia in buffalo (Bubalus bubalis). Acta Anat 1975; 93:219-227
Gunarajasingam D, Rajamahendran R, Downey BR, et al. Testosterone secretion in young and adult buffalo bulls. Theriogenology 1985; 24:185-95.
Guraya SS, Bilaspuri GS. Stages of seminiferous epithelial cycle and relative duration of spermatogenic processes in the buffalo (Bos bubalus). Gegenbaurs Morphol Jahrb 1976; 122:147-161.
Hess RA, de Franca LR. Spermatogenesis and cycle of the seminiferous epithelium. In: C Yan Cheng Landes (Eds). Molecular Mechanisms in Spermatogenesis. Bioscience and Springer Science 2008.
Kaur M, Bansal N, Uppal V. Histogenesis of testicular parenchyma during prenatal life in buffalo. Int J Morphol 2011; 29:1109-1114.
Mirabella N, Squillacioti C, De Luca A, et al. Seasonal reproductive activity and innervations of vas deferens and accessory male genital glands in the water buffalo. Italian J Anim Sci 2007; 6(Suppl 2):636-639.
McCool CJ, Entwistle KW. Reproductive function in the Australian Swamp buffalo bull: Age effects and seasonal effects. Theriogenology 1989; 31:583-94.
Narasimha Rao AV, Kottaya K. Age of puberty in Murrah buffalo bulls. Indian Vet J 1979; 56:252.
Pant HC, Sharma RK, Patel SH, et al. Testicular development and its relationship to semen production in Murrah buffalo bulls. Theriogenology 2003; 60:27-34.
Pawar HS, Wrobel KH. Quantitative aspects of water buffalo (Bubalus bubalis) spermatogenesis. Arch Histol Cytol 1991; 54:491-509.
Rajamahendran R, Sultan B. Effect of climatic environment on libido and semen characteristics of buffalo bulls in Sri Lanka. Phil J Vet Anim Sci 1987; 9:260.
Rahman MB, Vandaele L, Rijsselaere T, et al. Scrotal insulation and its relationship to abnormal morphology, chromatin protamination and nuclear shape of spermatozoa in Holstein-Friesian and Belgian Blue bulls. Theriogenology 2011; 76:1246-1257.
Roy KS, Bhatia H, Pathak D, et al. Prenatal development of testis in buffalo: A histomorphological study. Indian J Anim Sci 2009; 79:883-886.
Sayed AA, Oloufa MM, Badreldin AL. The semen of Egyptian buffaloes. Bull Fac Agric Cairo Univ (1962).
Taneja M, Ali A, Singh G. Ovarian follicular dynamics in water buffalo. Theriogenology 1996; 46:121–130.
Wrobel KH, Panwar HS. Morfología cuantitativa del epitelio tubular testicular en el búfalo de agua (Bubalus bubalis). Andrología 1992; 24:63-68.
Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo, Fisiología Reproductiva del Búfalo

