¿Que es el Salivazo?

El salivazo, es una de las plagas más importante de la caña de azúcar y las pasturas en varios países de América y El Caribe (Mora et al 2004).
El salivazo a la familia de los Cercópidos que en america tropical es una de las principales plagas que atacan a las gramíneas, en cultivos como la caña de azúcar son una plaga de importancia económica
Existen varias especies que difieren en sus hábitos alimenticios. En algunas especies las ninfas son de hábitos radicales y en otras se localizan en el follaje. Todas tienen en común el hábito de producir una masa espumosa en forma de saliva, lo que le confiere el nombre de “salivazo”.
Nombres comunes del Salivazo
Esta plaga tambien es conocida como: Mión de los Patos, salivita, Saliveros, Meones, Miones, Candelillas, Mosca Pinta, Cigarrinhas, Spittlebugs y Froghoppers
Clasificación taxonómica del Salivazo
Orden: Homoptera
Suborden: Auchenorryncha
Superfamilia: Cercopoidea
Familia: Cercopidae
Subfamilia: Tomaspidinae
Biología del Salivazo
Como todos los insectos del orden Homoptera, se desarrollan a través de una metamorfosis denominada hemimetabólica, la cual se caracteriza por no presentar fase larval y pupal; el huevo fértil eclosiona y da origen a una ninfa, la cual se desarrolla atravesando diferentes instares y la ninfa al final de cada instar sufrirá un muda y desarrollara las estructuras reproductivas y alares. luego que la fase ninfal llega a su fin se da una ultima muda que dará como resultado el insecto adulto. hay que aclarar aquí que este proceso tiene una característica algo peculiar y es que las ninfas jóvenes tienen una forma similar al insecto adulto (Calderón et al 1982).
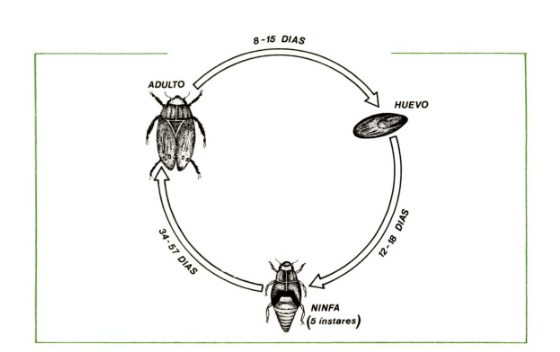
Fig 1: Ciclo de vida de la especie de salivazo Zulia Colombiana Lallemand.
Los Cercópidos solo pasan por 3 estados de desarrollo huevo, ninfa y adulto.
Huevo
Son alargados con una longitud de 1 mm promedio y 0.3 mm de diámetro ecuatorial, presentan una superficie lisa y de forma similar a la de un grano de arroz. Cuando son ovipositados recientemente presentaran un color amarillo crema, y al pasar la incubación se torna mas intenso el color hasta tomar un color rojizo o naranja antes de eclosionar (Calderón et al 1982).
Fig 2: Huevos de Zulia Colombiana en diferentes estados de desarrollo.

Al quinto día de la incubación aparecen 4 manchas rojizas: 2 de ellas aparecen cerca al polo anterior mas agudo y corresponden a los ojos del embrión y las otras 2 aparecen cerca al polo posterior y corresponden a los tubos de Malpighi. los huevos son depositados cerca o entre las raíces de los pastos, enterrados a 1-2 cm de profundidad; también pueden ser depositados sobre la superficie del suelo o sobre los estolones y residuos vegetales que estén en el suelo (Calderón et al 1982).
Tabla 1: Distribución de los huevos de Cercópidos según la profundidad en un suelo cultivado de caña de azúcar (Pickles 1993).
| Profundidad en cm | % Huevos |
| 0 – 2.5 | 60 – 70 |
| 2.5 – 5.0 | 18 – 26 |
| 5.0 – 7.5 | 9 – 16 |
Ninfas
Inmediatamente después de emerger, las ninfas buscan refugio en las partes húmedas y sombreadas de la base de las plantas y comienzan a alimentarse en las partes descubiertas de la raíz, en los rebrotes y estolones y en la parte basal del tallo. Desde que inicia la alimentación y durante todo el estado ninfal , el insecto se recubre con una espuma formada por una sustancia de consistencia mucilaginosa secretada por glándulas hipodérmicas grandes; estas glándulas se encuentran situadas al nivel de la región pleural del séptimo y octavo segmento abdominal y se denominan “Glándulas de Batelli “. La sustancia que secretan está compuesta en su mayor parte por un aminoazúcar y por el exceso de líquido que extraen de la planta (Calderón et al 1982).
Esta espuma o salivita protege a las ninfas de sus enemigos naturales y contra la desecación, creando un microclima favorable para su desarrollo. A este hecho se le deben los nombres de salivita, salivero o salivazo, con los cuales se conoce el insecto (Calderón et al 1982).
Fig 3: Masa de espuma o saliva bajo la cual se protegen las ninfas.

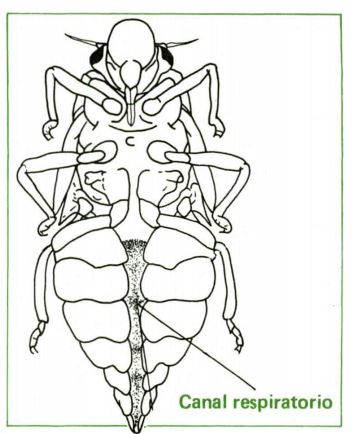
Las ninfas pueden morir en pocos minutos si se le expone a la radiación solar o a un ambiente muy seco. Después del primer instar, con una duración promedio de 6 días, empiezan a aparecer los rudimentos alares y zonas quinitizadas en el tórax. Además se observa un canal en la parte ventral que aloja los espiráculos, protegido por especies de aletas que salen de cada segmento abdominal. La ninfa pasa por cinco instares y en el último mide aproximadamente 9 mm de longitud, 3,0 mm de anchura de tórax, 2,35 mm de amplitud de la cápsula cefálica y 1,25 mm de amplitud de clypeus; presenta una abdomen de coloración rojiza, tórax y rudimentos alares de color negro y ojos marrón oscuro (Calderón et al 1982).
Fig 4: Vista ventral de la ninfa, con la localización del canal que aloja los espiráculos (Costa Lima, 1942).
La duración de la fase ninfal depende de la especie y de las condiciones ambientales. En condiciones de invernadero (26°C y humedad relativa de 80-90°), las ninfas de Zulia colombiana se desarrollaron en un promedio de 45 días, con un rango de 34 a 57 días (Calderón et al 1982).
El aparato bucal picador-chupador tanto de las ninfas como de los adultos, es un pico resistente, trisegmentado y doblado hacia arriba en su primer tercio anterior o rostrum. Dentro de este pico hay tres estiletes retráctiles que se mueven a lo largo del tubo para perforar los tejidos y extraer los jugos de la planta. En el último instar, la espuma que recubre a la ninfa se hace más densa y dura varios días hasta que ocurre la última muda y emerge el insecto adulto (Calderón et al 1982).
Adulto
El adulto presenta inicialmente un color blanco y permanece inmóvil durante varias
horas dentro de la masa espumosa. Al contacto con el aire , el cuerpo y las alas van adquiriendo lentamente su coloración normal por oxidación de sus pigmentos.
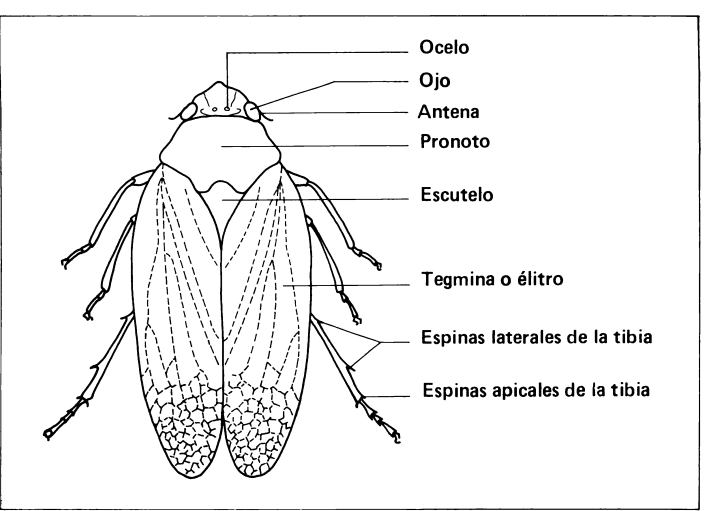
Completamente desarrollado , el adulto es un insecto de tamaño medio a pequeño y de forma suboval. Algunas características distintivas de los cercópidos incluyen su frente convexa y sobresaliente, con dos pequeños ocelos en medio de los ojos compuestos que son más protuberantes. Sus antenas son cortas y setáceas, con dos segmentos basales cortos y el resto filiforme. El pronoto es relativamente grande, de forma exagonal o trapezoidal (Calderón et al 1982).
La diferencia entre el macho y la hembra se hace con base en la conformación de la genitalia externa y El tamaño de los adultos, así como los patrones de coloración de los élitros , son características que varían según la especie (Calderón et al 1982).
Fig 5: Características morfológicas del adulto de un Cercópido.
Especies mas importantes del Salivazo
Existen 11 géneros de la familia cercopidae (Homoptera) con especies que atacan a las Gramíneas en las zonas neotropicales: Aeneolamia, Deois, Isozulia, Kanaima, Mahanarva, Maxatonia, Notozulia, Prosapia, Sphenorhina, Tunaima, y Zulia (Peck 2001). Todas esta especies de salivazo atacan pasturas desde el norte de Argentina hasta el sureste de los Estados Unidos.
Peck 2001 afirma que en Colombia se han reportado 15 especies de seis géneros que atacan a las gramíneas tanto cultivadas como silvestres, estas especies son: A. reducta (lallemand), A. bogotensis (Distant), A. lepidor (Fowler), A. varia (F.), M. andigena (Jacobi), M. phantastica Breddin, M. trifissa (Jacobi), N. entreriana (Berg), P. simulans (Walker), S. rubra (L.), Sphenorhina sp; Z. birubromaculata (Lallemand), Z. carbonaria (Lallemand), Z. pubescens (F.) y Zulia sp.
Las especies de mayor impacto económico en las pasturas tropicales son las de genero Zulia, Deois, y prosapia y algunas especies de Aeneolamia y Mahanarva.
A continuación se presenta una descripción de las características que permiten identificar a algunas de las especies más importantes, tal como han sido registradas por algunos investigadores de esta plaga.
Aeneolamia varia F.

Los adultos miden de 8 a 9 mm de longitud y son de color negro, con dos bandas transversales amarillas o anaranjadas sobre sus alas. Esta es la especie que presenta la mayor variación fenotípica ; hasta el momento se han identificado más de 20 subespecies según las variaciones de las bandas transversales y la conformación de las láminas subgenitales del macho. Estas características, aunque muy variables al considerarlas individualmente, son constantes al analizar un número grande de ejemplares en una población (Calderón et al 1982).
A. flavilatera Urich

El adulto puede llegar a tener una longitud de 6.5 a 9.5 mm y una anchura de 3 a 4.5 mm. La coloración del cuerpo es parda, con las alas semitransparentes bordeadas por una banda amarilla (Calderón et al 1982).
A. lepidior Fowl

Los insectos adultos de esta especie alcanzan unos 8 ó 9 mm de longitud y 4 mm de ancho. La cabeza, el pronoto y las patas son de color negro y las alas, amarillas o rojo anaranjadas. La franja proximal se encuentra en forma de seis manchitas dispuestas semicircularmente hacia la cabeza, tres en cada ala, siendo más grandes las marginales. La banda distal está compuesta por una mancha redondeada y marginal y por una o dos manchitas lineales cerca del margen sutural . La franja mesocutelar está bien definida y es más ancha y de color rojo más intenso que las otras bandas (Calderón et al 1982).
A. reducta montana Fennah
Son insectos de 6.5 a 7.5 mm de longitud y 2.5 a 3 mm de ancho. El color de la cabeza, el pronoto, el escutelo y la parte ventral es pardo claro , en tanto que las patas son de un tono más oscuro. Sobre las alas pardas también presentan dos rayas amarillas oblicuas que se asemejan a dos “V” divergentes hacia la cabeza (Calderón et al 1982).
A. flavilatera nirguensis Guagl.

Esta especie alcanza una longitud de 7 a 8 mm y 4 mm de anchura; es de coloración uniforme marrón y caoba oscuro por el dorso. Presenta en las alas bandas costales amarillo-naranja bien definidas y uniformes (Calderón et al 1982).
A. selecta selecta Walker
Esta especie llega a 7 mm de longitud y 4 mm de ancho. Es de color negro, con una franja continua amarillo-naranja en el tercio superior de las tegminas; además, presenta cuatro manchitas del mismo color en el tercio inferior de las mismas, las cuales pueden variar de tamaño e incluso desaparecer o invadir gradualmente todo el tercio inferior y superior de las tegminas (Calderón et al 1982).
A. postica Walker

Los adultos de esta especie en México miden de 7 a 9 mm de longitud y 5 a 6 mm de ancho. Son de forma oval , con cabeza de color negro brillante, cuerpo rojo- naranja, alas superiores de color pardo oscuro con dos franjas transversales amarillas o rojo claro y alas posteriores transparentes y membranosas (Calderón et al 1982).
A. selecta transversa Lallemand
Similar a la especie anteriormente descrita, pero sin las manchitas en el tercio inferior de las tegminas (Calderón et al 1982).
Deoisflavopicta Stal

Los adultos miden 9 mm de longitud ; su cabeza es de color oscuro, cubierta de pelos claros y cortos y más ancha que larga; frente fuertemente desenvuelta de color pardo, con margen entre tylus y ojos anaranjados. Los ocelos son amarillos y colocados sobre una elevación. El pronoto es muy elevado, oscuro y cubierto por pelos dorados. Las alas superiores son oscuras, con manchas y franjas
transversales anaranjadas; una en la base y otra casi en el ápice. La parte inferior del cuerpo y las patas son anaranjadas, en tanto que los tarsos son oscuros (Calderón et al 1982).
Deois incompleta Walker

Es una especie de color pardo claro , con una franja en “V” de color amarillo pálido en el margen interno superior de los élitros; presenta dos listas marginales externas del mismo color en forma de “S” y cuatro manchitas amarillas en el tercio inferior de las alas. Los machos miden 8 mm y las hembras 9 mm (Calderón et al 1982).
Deois schach F.

Insectos de 8 mm de longitud , con cabeza y pronoto de color verde pálido y élitros de color pardo oscuro con una franja transversal casi junto al ápice. Sobre el cuerpo y más densamente en la cabeza, presenta pelos blancos cortos. La parte inferior del cuerpo es roja, las patas son rojizas y los tarsos oscuros (Calderón et al 1982).
Deois schach solita Walker

Subespecie de color pardo oscuro a negro con cuatro manchas alargadas en el tercio inferior de las tegminas, las cuales varían de rojo a amarillo y pueden llegar a desaparecer totalmente. Su longitud varía entre 8 y 10 mm, siendo las hembras de mayor tamaño (Calderón et al 1982).
Deois terrea Germar

Especie de color pardo claro que puede llegar a ser transparente; presenta una lista amarilla en el margen interno de las alas. Mide 11 a 12 mm de longitud y 5 mm de ancho (Calderón et al 1982).
Zulia entreriana Berg

Es una de las especies menores de Brasil . Mide de 7 a 10 mm de longitud y su color es predominantemente negro . Se caracteriza por un marcado polimorfismo cromático en sus patrones alares, en ambos sexos, con listas verticales blancas hasta amarillo naranja variando en grosor hasta desaparecer y una franja constante del mismo color en el tercio inferior de las alas (Calderón et al 1982).
Zulia colombiana Lallemand
El color de las alas del macho es marrón, en tanto que las de la hembra son casi negras; en ambos sexos la cabeza y el pronoto son de color verde metálico y se encuentran recubiertos por pequeños pelos; el abdomen es de color rojo con negro, al igual que las patas. El macho mide 10.23 mm de longitud, 3.5 mm de anchura de tórax, 4.7 mm de anchura de cuerpo, 2.2 mm de amplitud de la cápsula cefálica y 0,95 mm de amplitud del clypeus; la hembra mide 10.72 mm de longitud, 3.7 mm de anchura de tórax , 5.0 mm de anchura del cuerpo, 2.6 mm de amplitud de la cápsula cefálida y 1.2 mm de amplitud del clypeus. Una característica interesante en esta especie es la presencia de manchas irregulares , transversales y anaranjadas en las alas tanto del macho como de la hembra. Se han encontrado de 0 a 5 manchas por ala en los machos y de 0 a 3 en las hembras (Calderón et al 1982).
Mahanarva fimbriolata Stal

Esta especie mide 13 mm de longitud y 5 mm de ancho ; los machos presentan una coloración más rojiza que las hembras, siendo éstas de color castaño oscuro . Ambos sexos poseen tegminas bordeadas de negro y en el centro de ellas presentan una franja longitudinal de igual color, siendo más larga en las hembras (Calderón et al 1982).
Mahanarva rubicunda indentata Walker
Los adultos miden 11 mm de longitud y presentan alas superiores de color pardo con las puntas más oscuras y atravesadas por dos líneas (Calderón et al 1982).
Mahanarva posticata Stal
Los machos miden 12 mm de largo y 5 mm de ancho, en tanto que las hembras miden 14 mm de largo y 6 mm de ancho . La coloración general es marrón – rojiza en los machos y más oscura en las hembras; el escutelo, el pronoto y la cabeza son de color marrón-verdoso en ambos sexos. Los machos se caracterizan por tener cuatro manchitas rojizas en el tercio inferior de las tegminas que son más oscuras. Los patrones de las alas en esta especie son más uniformes en cuanto a tamaño e intensidad del color. Se pueden reconocer tres razas ecológicas: M posticata campista (descrita anteriormente) ; M posticata ferrense (de colores más pálidos) ; y M. posticata capixaba (un poco mayor que las anteriores y de color rojo más intenso) (Calderón et al 1982).
Prosapia bicincta Say
El insecto adulto mide unos 10 mm de longitud ; dorsalmente parece de color rojo oscuro, casi negro, con dos bandas transversales estrechas de color naranja cerca de la porción media de las alas superiores. La parte central es de color rojo oscuro y el abdomen es casi negro. No es fácil distinguir los sexos a no ser que el macho tenga dos cercis curvados muy visibles. El ovipositor de la hembra es muy corto y robusto, cortado en punta y metido en una vaina cerrada en la parte baja del abdomen (Calderón et al 1982).
Hábitos del Salivazo
Las diferentes especies se comportan de manera similar. A continuación se hace referencia al comportamiento de estos insectos en los pastos. Los adultos son malos voladores y se desplazan principalmente mediante saltos; rara vez recorren distancias largas , sino que se mueven dentro de un radio de acción limitado. Los adultos de P. bicincta llegan a recorrer durante su vida unos 60 m en el pasto Pangola (Digitaria decumbens) y 80 en pasto Alemán (Echinochloa polystachya) (Calderón et al 1982).
Sus hábitos alimentarios son exclusivamente aéreos, extrayendo la savia de las hojas y parte alta de los tallos (Calderón et al 1982).
Sobre su comportamiento reproductivo, las siguientes son observaciones que se han hecho de la especie Zulia colombiana Lallemand en condiciones de laboratorio. Los adultos pueden tener su primera cópula luego de 2 horas de haber emergido; las cópulas pueden durar varias horas (hasta 8 horas) cuando no se les molesta. Presenta un período de preoviposición de 10 a 12 horas. Pueden realizarse varias cópulas tanto en machos como en hembras; se observaron cuatro en el laboratorio. La hembra oviposita un promedio de 67 huevos con un máximo de 130 durante su vida. El ciclo de vida del adulto oscila entre 8 y 15 días, con un promedio de 12 días; en algunos casos se ha observado que las hembras pueden durar más que el macho pero la diferencia no es significativa (Calderón et al 1982).
Daños E Importancia Económica del Salivazo
Los daños que causan los adultos a los pastos son los de mayor importancia, ya que ocasionan el secamiento del follaje . El ataque de las ninfas es menos drástico y el daño que causan es proporcional a su población (Calderón et al 1982).
Daño Causado por Ninfas
La picadura de las ninfas en las raíces y parte baja del tallo alcanza los haces vasculares y causa su deterioro, lo cual restringe o impide el paso de agua y nutrimentos a las partes aéreas de la planta. Además, las ninfas extraen grandes cantidades de líquidos de los pastos, agravando aún más el problema. Por consiguiente, el daño causado por las ninfas se manifiesta por una clorosis uniforme del pasto, el cual puede quedar totalmente amarillo como consecuencia del ataque ; las plantas también presentan síntomas semejantes a los causados por una deficiencia de agua, aún en plena estación lluviosa. La acción de las ninfas también afecta el crecimiento del pasto (Calderón et al 1982).
Daño Causado por adultos
Los daños más severos son causados por los adultos, ya que éstos provocan el secamiento del follaje, produciendo un síntoma típico que se conoce con los nombres de “quemazón”, “candelilla” o “blight”.
Al alimentarse, el adulto inyecta sustancias caústicas en el tejido, las cuales ocasionan la disolución del parénquima foliar. La saliva del insecto también contiene enzimas amilolíticas y oxidantes y varios aminoácidos que tienen un efecto tóxico y acciónmsistémica en el tejido de la planta (Guagliumi, 1969).
Control del Salivazo
Un buen manejo y control de las poblaciones de salivitas depende de un programa adecuado de control integrado, aplicando oportunamente los diversos medios de control disponibles: resistencia genética, control cultural, control biológico y control químico. Debido a la fuerte interacción que existe entre los factores insecto- planta-ecosistema , un buen programa de control debe basarse en un conocimiento adecuado de la biología de la especie o especies presentes en cada región, del comportamiento de las gramíneas existentes y de las condiciones prevalecientes en el ecosistema (Calderón et al 1982).
Control Biológico del Salivazo
El control biológico, basado en la utilización de algunos de los enemigos naturales de la plaga, es otro componente importante del control integrado de las salivitas. Estimulando la proliferación de estos agentes de control y liberando masivamente los agentes en el campo, se puede lograr una regulación apreciable de los insectos plaga. En condiciones de campo se han encontrado diversos enemigos naturales de las salivitas, los cuales atacan a la plaga en sus diferentes estados de desarrollo (Calderón et al 1982).
Se han identificado algunos microhimenópteros parásitos de huevos, varios insectos, arácnidos y vertebrados depredadores de ninfas o adultos, como también microorganismos patógenos que atacan las ninfas y adultos. Entre los últimos se destacan el hongo Metarhizium anisopliae (Metch.) Sorokin y un nemátodo no identificado, los cuales son promisorios como agentes de control biológico (Calderón et al 1982).
Control cultural del Salivazo
El control cultural comprende todas las prácticas agronómicas que tienen por objeto proporcionarle a las plantas condiciones favorables para su desarrollo y que pueden contribuir a darle una mayor capacidad de tolerancia a los ataques de la plaga y las medidas que tienden a crear un ambiente menos favorable para el desarrollo del insecto. No es posible dar recomendaciones de manejo válidas para todas las situaciones, ya que tanto las especies forrajeras como las especies de Miones pueden tener comportamientos diferentes de un ecosistema a otro, debido a la fuerte interacción plaga-hospedante y las condiciones ambientales (Calderón et al 1982).
Algunas de las medidas recomendadas incluyen:
.La siembra de gramíneas bien adaptadas a cada región que posean mecanismos de resistencia a los ataques del insecto.
.La diversificación de especies de gramíneas que, además de prevenir el incremento de la población de una especie del insecto, permite tener alternativas para pastoreo en las épocas de infestación.
.El uso estratégico del pastoreo mediante la utilización de cargas animales variables, también puede contribuir a regular las poblaciones de cercópidos.
Los criterios para la utilización del pastoreo dependen tanto de las gramíneas como de las condiciones del ecosistema, principalmente de la precipitación.
.El establecimiento de praderas mixtas de gramíneas y leguminosas compatibles. En general, las asociaciones leguminosa-gramínea, cócteles o cualquier otra práctica que incluya más de una especie de forraje, aumentan la heterogeneidad del ecosistema y favorecen una más amplia diversidad de especies de insectos y un mayor grado de equilibrio biológico natural.
Control químico del Salivazo
En términos generales, se recomienda evitar el uso de insecticidas en las praderas. Esto se debe a varias razones, de las cuales la principal es que estos productos tienen un efecto drástico en las poblaciones de fauna benéfica y rompen fácilmente el equilibrio biológico natural , que es frágil en estos ecosistemas por la poca variedad de especies vegetales y las grandes extensiones que generalmente ocupan (Calderón et al 1982).
Otras razones que restringen la utilización del control químico son las siguientes:
.Los insecticidas permanecen activos en el ambiente durante algún tiempo después de ser aplicados. Esto implica que la pradera no puede ser pastoreada hasta que el efecto residual del producto aplicado desaparezca para evitar la intoxicación de los animales.
.El control químico en pasturas implica altos costos, tanto por el valor de los productos como por los costos de aplicación, debido al carácter extensivo de la ganadería de pastoreo. Por lo tanto, desde el punto de vista económico, es muy poco viable este tipo de control (Calderón et al 1982).
.Los insectos que sobreviven a las aplicaciones van adquiriendo algún grado
de resistencia a los insecticidas; Evans (1973) hace referencia a la adquisición de resistencia al Carbaryl en un período de 4 años (12 generaciones) por cercópidos en Trinidad ; el mismo autor cita casos de resistencia al BCH y al Aldrin en un período de 6-7 años (Calderón et al 1982).
Control Integrado del Salivazo
Un manejo adecuado de las poblaciones de salivitas en los pastos requiere de un buen conocimiento de la especie o especies del insecto presentes en una región (JIMENEZ 1978).
No se puede hablar de un comportamiento general de la plaga, puesto que existen diferencias notables entre especies. Es importante conocer el ciclo biológico y la fluctuación de las poblaciones a través del tiempo, para determinar el momento oportuno para combatir la plaga con mayor efectividad, de tal forma que el control no sea momentáneo sino que persista en las generaciones sucesivas (JIMENEZ 1978).
Referencias Bibliográficas
Calderón. M; Arango. G; Varela. F. 1982. Cercópidos plagas de los pastos en América Tropical . Biología y Control. CENTRO INTERNACIONAL DE AGRICULTURA TROPICAL (CIAT). Cali – Colombia.
COSTA LIMA, 1942. Insectos de Brasil . Tomo 3, CAP. XXIII . Escuela Nacional de Agronomía, Brasil . Serie Didáctica No. 4. pp. 65-799.
EVANS, D. E. 1973. Resistence to Carbamate insecticides in Aeneolamia varia saccharina (DIST. ) Tropical Agricultura, 50 ( 2) : 153-163.
GUAGLIUMI, P. 1969. Las cigarrinhas dos canaviais no Brasil . III Contribución. Aspectos generales del problema, con especial referencia a Mahanarva posticata en los Estados de Pernambuco y Alagoas. Turrialba (Costa Rica) . 119 (3) : 321-331.
JIMENEZ, J. A. 1978. Estudios tendientes a establecer el control integrado de las salivitas de los pastos. Rev. de la Soc. Col. de Entomología, Colombia 4 ( 1-2) : 19-33.
Mora. J; Moreira. K; Alvarado. D. 2004 El Salivazo de la Caña de Azúcar, Mahanarva andigena (HOMOPTERA, CERCOPIDAE).
Peck. D. 2001. Diversidad y distribucion geografica del salivazo (Homeoptera: Cercopidae) asociado con gramíneas en Colombia y Ecuador. Rev. Colomb. Entomol. 27(3/4):129-136.

